近日,杭州博日科技股份有限公司完成质量体系的“医疗器械单一审核程序”认证,并获得国际认证机构BSI颁发的 MDSAP 认证证书,该认证包含美国、日本、巴西、加拿大、澳大利亚五个国家,将有助于进一步打开国际市场。

什么是MDSAP?
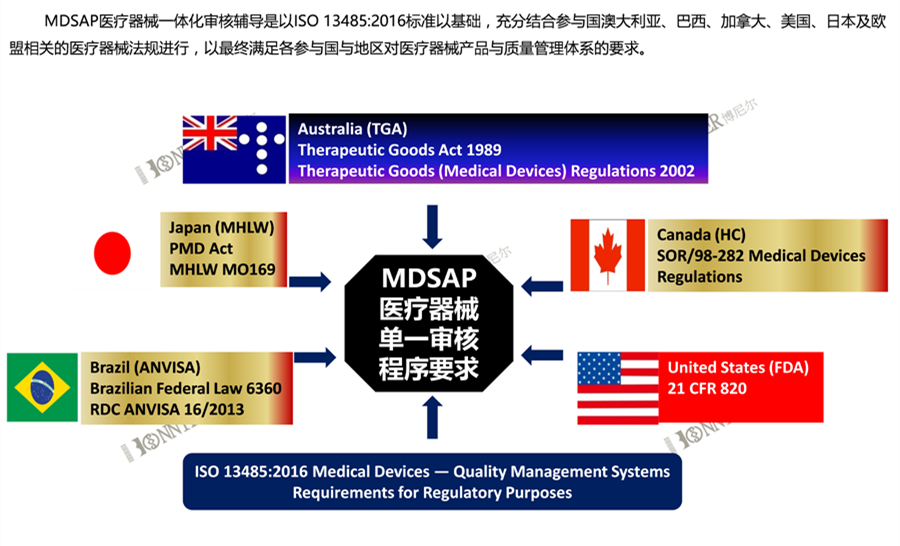
MDSAP是Medical Device Single Audit Program的英文首字母缩写,即“医疗器械单一审核程序”,MDSAP认证项目是美国(FDA)、澳大利亚(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五国的监管机构认可并加入的一套新的审核程序。值得一提的是,该项认证可在上述国家替代部分审核和常规检查、获得市场准入,因此认证要求较高。
什么是BSI?
英国标准协会(BSI)是英国国家标准机构,全球领先的标准制定机构,英国皇家特许机构。总部位于英国。英国标准协会连续十二年被国际公认品牌裁决机构选为全球性超级品牌。
MDSAP认证相关国家认可的程度如下:
美国:替代FDA的常规检查(FDA专项和PMA产品除外);
巴西:对于三类和四类医疗器械,可以替代ANVISA的上市前GMP检查,以及上市后的例行检查(专项检查除外);
日本:对于II类,III类,IV类医疗器械,可豁免现场工厂审核;
加拿大:2019年起强制取代CMDCAS,作为分类在II类及以上产品进入加拿大的唯一途径;
澳大利亚:可豁免TGA审核,支持颁发和保持TGA符合性审核证书。
MDSAP认证与ISO13485认证的异同:
ISO13485是MDSAP的基础;MDSAP认证的要求要高于/多
ISO13485的要求;
ISO13485是标准,MDSAP除了ISO13485之外,还有各参与国的法规要求;
SO13485和MDSAP两种认证,核心都是质量管理体系。
质量为企业生存之根本;质量为企业发展之灵魂
2002年,博日科技取得TUV南德认证欧盟EN46000。
2004年,通过德国TUV南德的ISO9001质量管理体系和ISO13485-2003医疗器械质量管理体系的认证。
2020年,通过华知GB/T29490-2013知识产权管理体系认证。
2022年,通过BSI颁发的 MDSAP 认证。
作为中国PCR行业的领军者与开拓者,经过二十年国际市场磨砺和检验,博日科技以创新能力和产品质量赢得全球客户的信任。究其原因是公司牢固树立了“质量为企业生存之根本,质量为企业发展之灵魂”的质量理念,像珍视生命一样注重质量管理,大力弘扬质量文化,守住质量底线,在产品质量、服务质量和管理质量等方面全系统、全流程协同发力,推动公司打造PCR产业高质量发展高地。

